Примеры комплексовМатериалы / Современное содержание термина "активация" / Примеры комплексовСтраница 1
А) гидридные комплексы (например, гидриды рения). В комплексе рения [ReH9]2- шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре этого треугольника.
б) галогенидные комплексы:
Например, соединение K2PdCl4 является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4)2- (см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:

Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н-) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5Cr]2(μ-H) или рения (CO)3Re(μ-H)3Re(CO)3.
: 
В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –

Примером может служить кластерный комплекс платины состава Pt4(OCOCH3)8 :

В кластере четыре атома платины образуют квадрат с коротким расстоянием металл-металл. По каждой стороне квадрата координированы по две мостиковых ацетатных группы. В координации каждой ацетатной группы участвуют в одинаковой мере оба карбоксилатных атома кислорода, поставляя для образования донорно-акцепторной связи пару электронов с каждого атома кислорода, а еще один электрон делокализован между этими двумя атомами кислорода.
3. Лигандами могут быть устойчивые двухатомные и многоатомные молекулы:
N2, O2, CO, NO, NH3, NR3, H2O, R2O, SO2, CS2, PR3, RCN, C6H6
ПРИМЕРЫ:


Ni(CO)4 Co2(CO)8
В тетракарбониле никеля Ni(CO)4 атом металла помещен в центр тетраэдра, образуемого 4 атомами углерода карбонильных групп, поэтому комплекс имеет тетраэдрическое строение. В �иядерном дикобальтоктакарбониле Co2(CO)8 каждый атом кобальта имеет квадратно-пирамидальное окружение, причем основание квадратной пирамиды образуют 4 атома углерода карбонильных групп, а вершину этой пирамиды – второй атом кобальта.
В сэндвичевых соединениях – дибензолхроме (C6H6)2Cr и ферроцене (C5H5)2Fe атом металла располагается между двумя плоскими ароматическими молекулами, каждая из которых связана с атомом металла по π-типу:


4. Лигандами могут служить молекулы или фрагменты молекул, которые не существуют в свободном состоянии или являются чрезвычайно неустойчивыми (карбены, карбины, нитрены и т.д.)
Карбеновые комплексы:
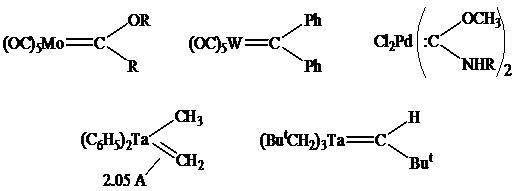
Карбиновые комплексы

Нитреновые комплексы – это фактически азотсодержащие аналоги карбенов, где нитреновый лиганд связывается с центральным атомом за счет кратной связи металл-азот, как, например, в комплексе рения:
![]()
Классификация комплексов по специфике электронной конфигурации лигандов.
Этот тип классификации уже в какой-то мере отражает особенности химической связи металл-лиганд.
