Обратимые реакцииМатериалы / Сложные реакции. Типы реакций / Обратимые реакции
Пусть обратимая реакция ![]() имеет первый порядок в обоих направлениях. Обозначим через a и b – начальные концентрации, а через х – уменьшение концентрации исходного вещества к моменту времени τ или количество прореагировавшего вещества.
имеет первый порядок в обоих направлениях. Обозначим через a и b – начальные концентрации, а через х – уменьшение концентрации исходного вещества к моменту времени τ или количество прореагировавшего вещества.
В соответствии с принципом независимости суммарная наблюдаемая скорость реакции есть сумма независимых скоростей прямой и обратной реакций, т.е.
![]() (1)
(1)
Такие реакции, в отличие от необратимых, доходят в пределе, когда ![]() , не до конца, когда
, не до конца, когда ![]() , а до состояния равновесия, при котором общая скорость реакции равна нулю.
, а до состояния равновесия, при котором общая скорость реакции равна нулю.
![]() (2)
(2)
здесь ![]() - изменение концентрации исходного вещества, соответствующее равновесию; его количество, вступившее в реакцию к моменту наступления равновесия.
- изменение концентрации исходного вещества, соответствующее равновесию; его количество, вступившее в реакцию к моменту наступления равновесия.
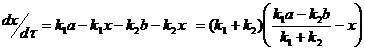 (3)
(3)
Приравнивая выражение ![]() к нулю, что соответствует равновесию, получим:
к нулю, что соответствует равновесию, получим:
![]() , откуда
, откуда
![]() (4)
(4)
Подставляя (4) в (3):
![]() (5)
(5) 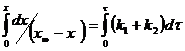
![]() (6)
(6)
Полученное уравнение (6) имеет сходство с уравнением для необратимой реакции 1-го порядка. Разница в том, что в полученном уравнении вместо начальной концентрации стоит величина ![]() , а в правой части уравнения мы имеем сумму констант прямой и обратной реакции.
, а в правой части уравнения мы имеем сумму констант прямой и обратной реакции.
Каждую из констант k1 и k2 можно вычислить, если провести термодинамический расчет и определить ![]() . По величине
. По величине ![]() можно вычислить равновесные концентрации и
можно вычислить равновесные концентрации и ![]() . Т.о., экспериментально определяя х для какого-либо τ, можно вычислить каждую из констант k1 и k2.
. Т.о., экспериментально определяя х для какого-либо τ, можно вычислить каждую из констант k1 и k2.
Смотрите также
Углерод (Carboneum), С
Углерод - химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Известны два стабильных изотопа: 12C (98,892%) и 13C (1,108%). Из радиоактивных изотопов ...
Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов
Данная
дипломная работа посвящена синтезу и изучению магнитных сорбентов,
представляющих собой магнитный (либо намагниченный) материал с высокими
адсорбционными свойствами.
Преимущество
...
Интерполиэлектролитные комплексы
Полимеры - химические соединения с высокой молекулярной массой (от
нескольких тысяч до многих миллионов), молекулы которых (макромолекулы) состоят
из большого числа повторяющихся группировок ...
