Односторонние реакции 2го порядкаМатериалы / Скорость образования, расходования компонента и скорость реакции / Односторонние реакции 2го порядка
Это реакции вида:
А1+ А2 = Продукты.
Выражение для скорости реакции имеет вид:
W = K2C1C2, (14)
где С1 и С2 - концентрации веществ А1 и А2 в момент времени τ протекания реакции;
К2 - константа скорости реакции 2го порядка. С другой стороны скорость реакции можно представить через изменения концентрации исходных веществ во времени:

При vi = 1.
После подстановки этих соотношений в уравнение (14) получим:
 (15)
(15)
Обозначим x - уменьшение концентрации исходных веществ с течением реакции. Тогда
при τ = 0, С1 =С01, С2 =С02;
при
τ >
0,
С1 =
С01 - х
,
С2= С02 - х ,
где С01 и С02 начальные концентрации веществ A1 и A2, Из равенств для времени τ >
0 в общем виде:
Сi =
С0i - х, dСi =
-d х.
Подставим приведенные соотношения в уравнение (15) и получим:
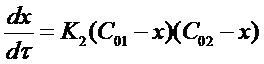
Разделим переменные в полученном выражении и проведем некоторые преобразования:

Окончательно можно записать:

Проинтегрируем выражение в пределах от τ = 0 до τ и от х = 0 до х:

После решения интегральных выражений получим:

Откуда:
 (16)
(16)
При выводе формулы для расчета К2 использовано вычисление неопределенного интеграла

Из уравнения (16), после небольших его преобразований, можно получить выражение для расчета х .
Представим формулу (16) в виде:

После потенцирования получим

Откуда

В частном случае, когда С01 = C02 = C0 уравнение скорости односторонней реакции второго порядка примет вид (при v = 1):
 (17)
(17)
Если использовать значение х, то производная:
 (18)
(18)
Разделим переменные в уравнениях (17) и (18), проинтегрируем первое в пределах от 0 до τ и от С0 до С, второе от 0 до τ и от 0 до х:

Откуда

(19)
Если уравнение разрешить относительно К2, то получим:

Интегрирование
уравнения (18)

после решения для определения К2 дает формулу:

Константу скорости К2 определяют экспериментально. При этом используют уравнения (16) или (19) в виде:

Приведенное уравнение в системе координат (
) дает
прямую линию. Тангенс угла наклона этой линии, построенной по экспериментальным данным, равен константе скорости изучаемой реакции (рисунок 3).

Рисунок 3 - Графическое определение константы скорости реакции второго порядка
Смотрите также
Коллоиды как лекарственные средства.
Столь чужеродно звучащее слово «коллоид» происходит от греческого
слова «коlla» – клей. Коллоиды знакомы нам под другими названиями. Так,
большие молекулы протеинов, полисахаридов и нуклеиновых кисл ...
