Реакция
этерификации и гидролиз сложных эфировМатериалы / Синтез изоамилового эфира уксусной кислоты реакцией этерификации (гидролиза) сложных эфиров / Реакция
этерификации и гидролиз сложных эфировСтраница 1
Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров:
![]()
В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего бедный электронами углеродный атом карбонильной группы.
Реакции этерификации обратимы и, следовательно, ограничены состоянием равновесия. Превращение эквимолекулярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира по причине обратимости реакции невозможно. В результате реакции образуется некоторое максимальное количество эфира (которое всегда ниже теоретического) и остаются непрореагировавшие спирт и кислота. Например, при нагревании с обратным холодильником эквимолекулярных количеств уксусной кислоты и этилового спирта в реакцию вступает лишь 2/3 г-мол каждого компонента, поэтому максимальный выход эфира в этих условиях составляет лишь 2/3 теоретического, т. е. 66,7%.
![]()
По мере того как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (эфира и воды), скорость обратной реакции, вначале незначительная, возрастает. При этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько же молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Одинаковой скоростью этих противоположно протекающих процессов обусловлен постоянный состав системы. Поскольку скорость бимолекулярной реакции пропорциональна произведению концентраций реагирующих веществ, мы можем для скоростей прямой и обратной реакций написать уравнения:

где v1 — скорость реакции этерификации; v2 — скорость реакции гидролиза; К1 и К2 — константы скорости обеих реакций; Ск, Сс, Сэ и Св — концентрации реагирующих и получающихся веществ (кислоты, спирта, эфира, воды).
В состоянии равновесия скорости реакций, протекающих в противоположных направлениях, равны, т. е. V1 = V2. Тогда К1СкСс = КгСэСв или:

Частное К2/К1 является константой равновесия и обозначается буквой К.
Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому
![]()
Однако можно изменить состояние равновесия и повысить выход сложного эфира, увеличивая концентрацию спирта (или кислоты). Например, если взять уксусную кислоту и спирт в молярном отношении, равном 1:2, выход эфира (из расчета на кислоту) повышается до 85%. Действительно, пусть концентрация эфира в состоянии равновесия (в молях) будет равна х, т. е. Сэ = х. Тогда и Св = х. Концентрация кислоты Ск = 1—х, концентрация спирта Сс = 2 — х. Следовательно,
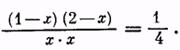
После решения этого уравнения находим, что х = 0,85 моля, то есть выход эфира равен 85% теоретического.
Часто применяется и другой способ смещения равновесия в сторону большего выхода сложного эфира — удаление сложного эфира или воды из сферы реакции. Легко можно видеть, что уменьшение концентраций эфира или воды влечет уменьшение концентраций спирта и кислоты, поскольку величина константы равновесия К при данной температуре неизменна. Так, в случае получения низкокипящих сложных эфиров (например, уксусно-этилового с температурой кипения 77°С) в ходе реакции отгоняют эфир из реакционной колбы. При получении высококипящих сложных эфиров (например, уксуснобутилового с температурой кипения 125°С или уксусноизоамилового с температурой кипения 142°С) удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропа с парами соответствующего спирта. При конденсации паров в холодильнике происходит расслоение этих ограниченно смешивающихся жидкостей и вода, как более тяжелая, собирается на дне поставленной на пути конденсата «ловушки» (см. рис. 27). Азеотропную отгонку воды можно использовать и в случае этерификации кислот этиловым или пропиловым спиртом, которые в жидкой фазе смешиваются с водой во всех отношениях. В этом случае для отделения воды от сконденсировавшегося в холодильнике спирта в реакционную смесь приходится добавлять третий компонент, образующий с водой и спиртом нераздельно кипящую смесь, но в жидкой фазе с водой не смешивающийся. Его роль состоит в том, что он экстрагирует из конденсата спирт и возвращает его в реакционный сосуд. В качестве такого компонента могут использоваться бензол, хлороформ, четыреххлористый углерод и некоторые другие жидкости, но из перечисленных только бензол можно использовать в «ловушках». Хлороформ и четыреххлористый углерод обладают большей плотностью, чем вода, и для отделения воды от реакционной смеси в случае использования этих жидкостей требуется «ловушка» другой конструкции.
Смотрите также
Приложение 8
Тему “Углерод,
подгруппа углерода.” можно завершить зачетным уроком по составлению
обобщающей схемы, которая пригодится для сдачи экзамена по химии и приведет в
систему знания учащихся, дополняя в ...
Бром (Bromum), Br
Бром - химический элемент VII группы периодической системы Менделеева, относится к галогенам; атомный номер 35, атомная масса 79,904; красно-бурая жидкость с сильным неприятным запахом. Б. откры ...
